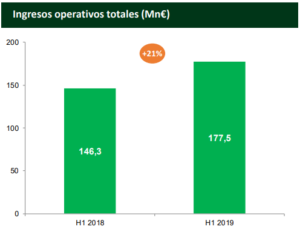
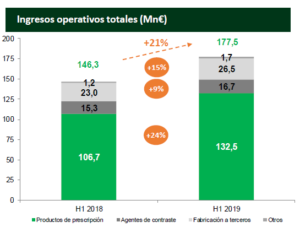
Laboratorios Farmacéuticos ROVI ha comunicado a la Comisión Nacional del Mercado de Valores (CNMV) los principales resultados financieros del primer semestre de 2019. Así, en este período, los ingresos operativos aumentaron un 21%, hasta alcanzar los 177,5 millones de euros en el primer semestre de 2019.
La división de heparinas de bajo peso molecular aumentó sus ventas un 43% en el primer semestre de 2019. Concretamente, las ventas del biosimilar de enoxaparina alcanzaron los 36,5 millones de euros en el primer semestre de 2019 y las de Bemiparina crecieron un 5% en España, hasta los 35,5 millones de euros.
CRECEN LAS VENTAS DE PRODUCTOS DE PRESCRIPCIÓN Y FABRICACIÓN A TERCEROS
En los primeros meses de 2019, han crecido las ventas del negocio de especialidades farmacéuticas un 22%, así como las del fabricación a terceros, un 15% más.
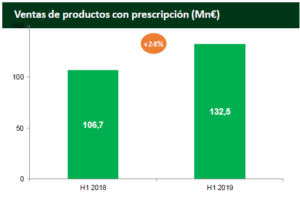
En este campo, las ventas de Neparvis® (producto de prescripción de Novartis que Rovi distribuye en España desde diciembre de 2016 y que está indicado para el tratamiento de pacienes adultos con insuficiencia cardiaca crónica sintomática y fracción de eyección reducida) se incrementaron un 63% hasta alcanzar los 9,6 millones de euros.
Volutsa®, producto de prescripción de la compañía Astellas Pharma indicado para el tratamiento de los síntomas moderados a graves de llenado y de vaciado asociados a la hiperplasia prostática benigna, ha registrado unas ventas de 6,4 millones (un 20% más).
Las ventas de agentes de contraste para diagnóstico por imagen y otros productos hospitalarios aumentaron un 9%, hasta los 16,7 millones de euros.
Asimismo, las ventas de fabricación a terceros crecieron un 15%, representando 26,5 millones de euros en el primer semestre de 2019, impulsadas por la división de inyectables cuyas ventas crecieron un 53% en el período.
El EBITDA (beneficios antes de impuestos) alcanzó los 26,5 millones de euros en el primer semestre de 2019. Este dato representa un crecimiento del 99% comparado con el mismo periodo del año anterior. El beneficio neto se incrementó en un 114% hasta los 16,2 millones de euros.
Todos estos datos positivos han obligado a Rovi a revisar al alza, por segunda vez consecutiva en el año, su previsión de ingresos operativos para 2019, que ahora se sitúa entre el 16 y el 19%.


































